高レベル放射性廃棄物の処分
~アクチニド元素や核分裂生成物の溶解度や化学状態に関する熱力学的研究~
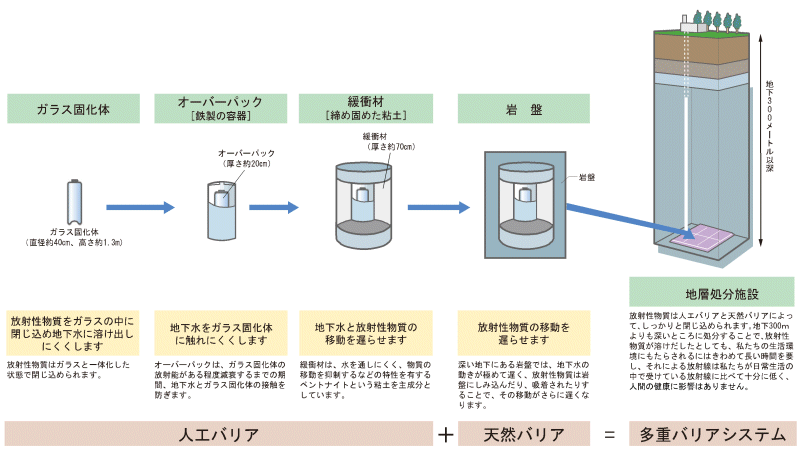
放射性廃棄物を出来る限り長い間閉じ込めるために、人工的に作られた幾重もの障壁(バリア)を備えるような工学的対策が考えられています。 また地下深部の地層が本来持っている物質の閉じ込め力を利用することは言うまでもありません。そのような地層処分は既存技術で可能なのか、現状で十分安全といえるのか。 これまでに様々な角度から多くの研究、それに基づく議論と改良が積み重ねられ、 技術的信頼性が確保されてきた今日ですが、更に信頼性の高いあり方を目指すことが重要です。
我々が進めている研究課題は、放射性核種の物理化学的な挙動を熱力学的に理解することが中心です。 特に、3価および4価金属イオンであるプルトニウム、ウラン、トリウム、アメリシウムなどのアクチノイド元素や、ジルコニウム、セシウム、ヨウ素などの核分裂生成物に注目しています。 これらの放射性核種は、地下水中で様々な要因のもとで非常に複雑な挙動を見せることがあり、 科学者の間でも統一的見解が得られていない現象がまだ多くあります。 自然環境でのこうした核種の挙動を予測しうる基礎を築くことが、 地層処分の信頼性を向上させることにもつながります。 主な研究課題は以下の通りで、幾つかの最先端の研究は欧米やアジア、 国内の研究機関と共同で進められています。
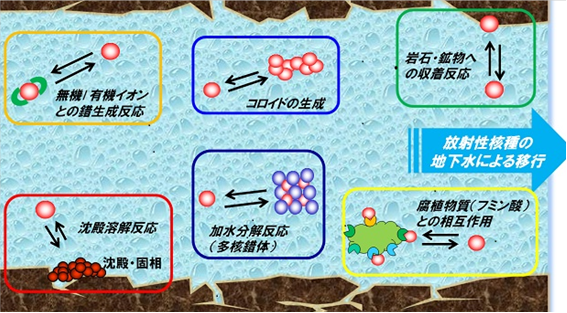
高レベル放射性廃棄物およびTRU廃棄物に含まれる長半減期の放射性核種は様々な化学反応プロセスを経て地下水中を移行します。移行挙動をより正確に予測するためには、地下水中の放射性核種の化学状態を把握することが重要です。
無機・有機イオンとの錯生成反応
地下水中には様々な無機および有機イオンが存在しています。無機イオンには、塩化物イオン、硫酸イオン、炭酸イオンなど、有機イオンには、廃棄物に由来するシュウ酸やイソサッカリン酸、天然のフミン酸などが含まれます。これらの無機および有機イオンが放射性核種と安定な錯体を形成することにより、「見かけの溶解度」が変化します。 私たちの研究室では、主に多価の金属イオンと無機および有機イオンの錯生成反応に着目し、熱力学平衡反応に基づく解釈を進めています。
4価ジルコニウムと炭酸イオンの錯生成反応
炭酸イオンは地下水中に普遍的に存在する無機イオンであり、特に多価金属イオンと安定な錯体を形成します。一方、ジルコニウムは、4価アクチノイドの化学アナログとされるとともに、放射性同位元素(Zr-93)は核分裂生成物として放射性廃棄物にも含まれます。地下水中で4価イオンとなるジルコニウムは、難溶性アモルファス水酸化物(Zr(OH)4(am))を形成しますが、炭酸イオン共存下では、ジルコニウム炭酸錯体を形成することにより見かけの溶解度が上昇する可能性があります。
このとき、ジルコニウム水酸化物の溶解沈殿反応および炭酸錯体の錯生成反応は下式のように表され、それぞれの平衡定数を溶解度積(Ksp)および錯生成定数(β1xy)と呼びます。
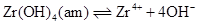
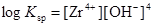
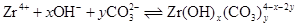
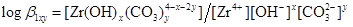
ジルコニウムの溶解度([Zr]tot)は下式で表される溶存化学種の濃度和です。
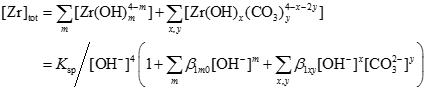
また、溶解度積および錯生成定数は、溶液のイオン強度によって変化します。これはイオン強度に応じて各イオンおよび錯体の活量が変化するためです。あるイオン強度Imでの錯生成定数β1xyは、SIT(Specific ion interaction method)を用いて下式のように表されます。
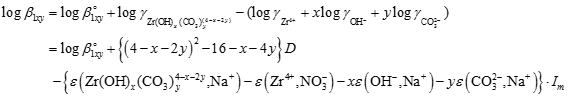
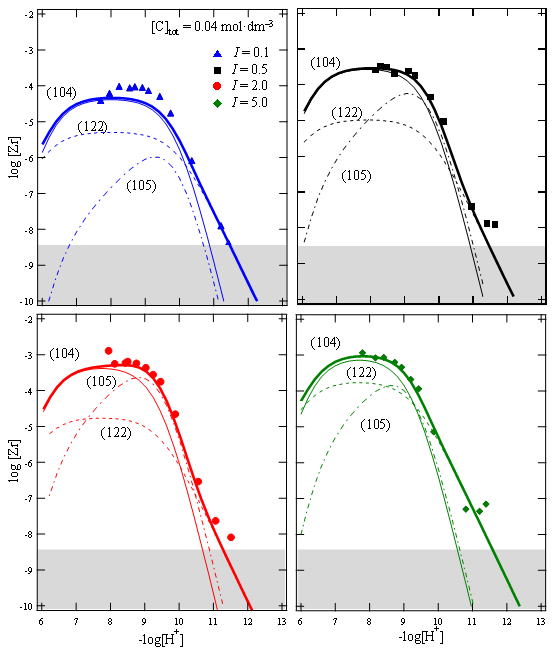
ここで、β°1xyは無限希釈溶液(I=0)での錯生成定数、Dはデバイヒュッケル項、εはイオン相互作用係数と呼ばれる値です。 本研究では、様々なpHおよび炭酸イオン濃度およびイオン強度条件下でのジルコニウム溶解度を測定し、支配的なジルコニウム炭酸錯体を明らかにするとともに、その錯生成定数やイオン相互作用係数の値を求めました。図は0.04 M(mol/dm3)の炭酸イオン共存下におけるジルコニウム溶解度をイオン強度毎に示したものです。Zr(CO3)44-やZr(CO3)56-、Zr(OH)2(CO3)22-が支配的な溶存種であることやイオン強度の増加とともに溶解度が1桁程度上昇することなどが示されています。
4価トリウムとシュウ酸イオンの錯生成反応
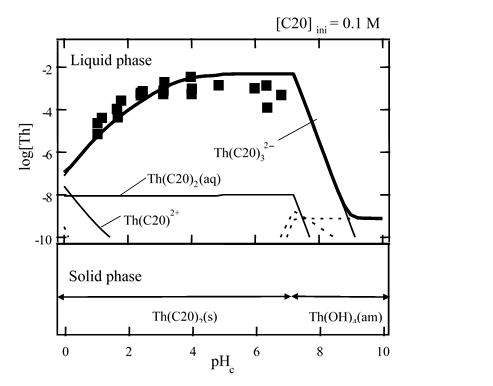
シュウ酸((COOH)2)は単純な構造のジカルボン酸であり、廃棄物に含まれる様々な有機物の分解生成物の一つと考えられています。2つのカルボキシル基によるキレート配位により様々な金属イオンと安定な錯体を形成することが知られています。本研究では、4価アクチノイドであるトリウム(232Th)を用いて、シュウ酸との錯生成反応を調べました。 様々なpHおよびシュウ酸濃度条件下でのトリウム溶解度を測定したところ、酸性pH条件ではシュウ酸濃度の増加とともにトリウム溶解度が低下する傾向が見られました。図は固相の熱重量-示差熱分析(TG-DTA)を行った結果です。200、300および400℃付近にそれぞれ吸熱ピークと重量減少が見られ、固相はトリウムのシュウ酸化合物(Th(C20)2(s))と考えられました。
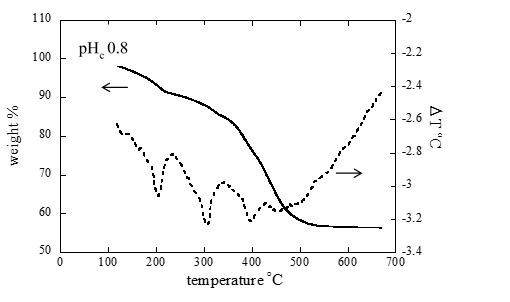
トリウムのアモルファス水酸化物(Th(OH)4(am))に加えてTh(C20)2(s)を溶解度制限固相に取り入れることにより、トリウムの溶解度を定量的に解釈することができました。
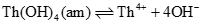
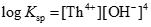
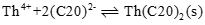
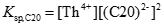
加水分解反応(多核錯体の生成)
4価アクチニドは強い加水分解反応により、水溶液中で様々な水酸化物錯体を形成します。このとき、単核の水酸化物錯体のみならず、多核錯体が生成します。水酸化物錯体を含む4価アクチノイドの見かけの溶解度を定量的に評価するためには、生成する多核錯体種を同定するとともにその錯生成定数を求める必要があります。
私たちの研究室では、多核錯体を検出する手法として、エレクトロスプレーイオン化質量分析法(ESI-MS)を用いた測定を行っています。ESI-MS法は、高電圧をかけたガラスキャピラリーの先端から試料溶液を噴霧し、脱溶媒和管を通して質量分析部へと導くことにより溶液中の錯体構造を壊すことなく測定できる分析手法です。
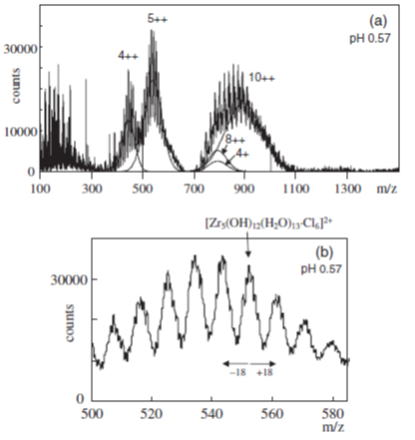
下図はpH 0.57の塩酸溶液中で生成するジルコニウムの多核錯体のESI-MSスペクトルを表しています。4核、5核、10核の水酸化物錯体のスペクトルが見られています。m/z = 18毎に表れるスペクトルのパターンは溶媒の水分子の数の変化を示しています。pH条件の異なる試料溶液のESI-MSスペクトルを測定し、ピーク面積を比較することにより、多核錯体の錯生成定数を求めました。
腐植物質(フミン酸)との相互作用
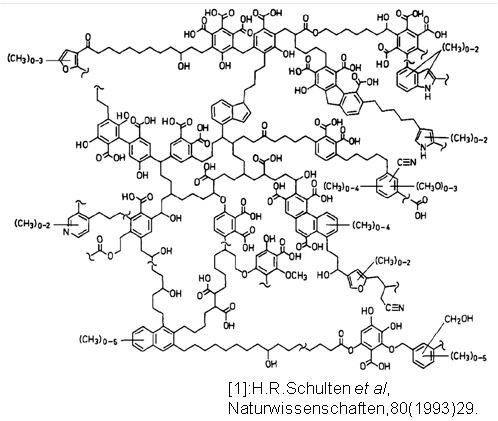
動植物の遺骸の分解により生じる最終生成物であるフミン酸やフルボ酸と呼ばれる腐植物質(フミン物質、天然有機化合物とも)は、地下水や土壌中に普遍的に存在し、放射性核種と相互作用します。下図にフミン酸の2次元分子構造の推定例を示します。これらは様々な配位官能基からなる複雑な構造(不均質性)をもつため、液性条件に応じた相互作用の強さをどのように定量化すべきかが課題となっています。
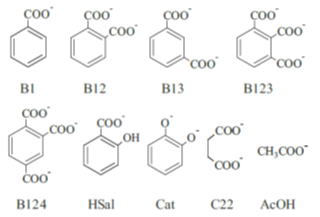
私たちの研究室では、様々な官能基からなるフミン酸を単純な配位子の集まりと想定し、フミン酸の錯生成能をこれら配位子の和で表すことを試みました。これまで、3価希土類元素や4価アクチニド元素の錯生成定数を、溶媒抽出法やイオン選択性電極を用いて実験的に取得するとともに、フミン酸を構成する以下の単純な配位子との錯生成定数の加成則による解釈を進めてきました。下図はフミン酸を構成するとして仮定した9つの官能基です。 これら官能基が単独、あるいは組み合わさることによりフミン酸の配位サイトを形成するとし、表に示すような54種類の配位サイトを考えました。
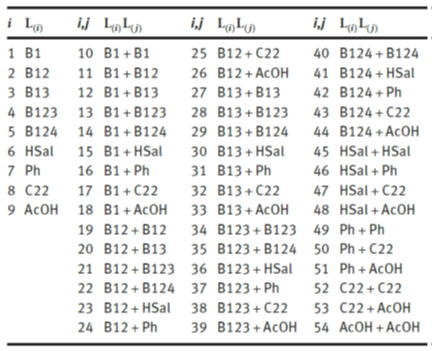
金属イオン(Mn+)と単座の配位サイトL(i)または二座の配位サイトL(i)L(j)の錯生成反応は下式で定義できます。
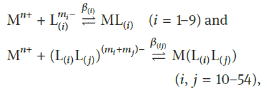
また、見かけの錯生成定数β’は下式で定義されます。
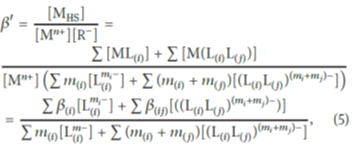
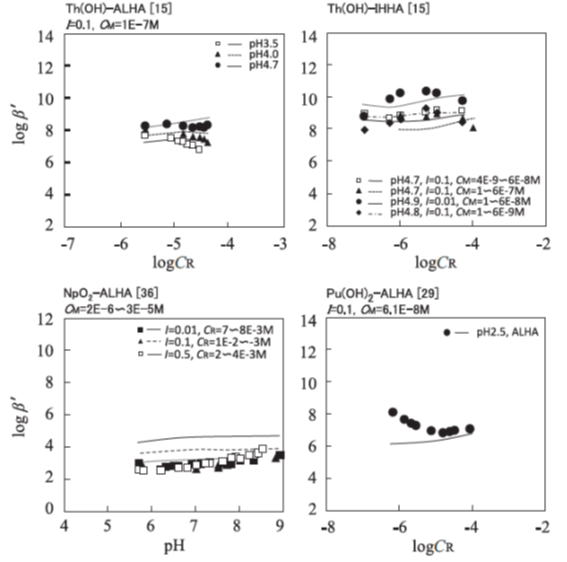
ここで、[MHS],[Mn+],[R-]は、それぞれ金属フミン酸錯体、錯生成していない金属イオンおよび錯生成していない配位サイトの濃度を表します。見かけの錯生成定数の実験値とモデルによる値を比較した結果の一例を図に示します。
岩石・鉱物への収着
放射性核種が処分場周辺母岩や緩衝材(粘土鉱物)表面に収着することで、その移行速度が遅延することが期待されます。どの核種がどのようにどれくらいの強さで収着するのか、様々な地下水環境を想定した収着データの蓄積、反応メカニズムの理解、そしてより信頼性の高い安全評価に向けたモデルの構築が重要です。
一例として3価ユーロピウムのナトリウム型モンモリロナイトへの収着挙動に関する研究を紹介します。ユーロピウムはアメリシウムやキュリウムなどの3価アクチノイドの化学アナログ、ナトリウム型モンモリロナイトは粘土系鉱物の一種です。
下図はユーロピウム(Eu)のナトリウム型モンモリロナイトへの分配係数Kdをバッチ式収着試験によって測定した結果です。分配係数Kdは液相と固相中のEu濃度の比として下式により定義されます。
Kd=([Eu3+]ini − [Eu3+]aq)/[Eu3+]aq × (V/W)
ここで、[Eu3+]iniはEuの初期濃度、[Eu3+]aqは液相中のEu濃度、Vは溶液量、Wはナトリウム型モンモリロナイトの重量を表します。

分配係数Kdの値は、pHの上昇とともに増加するような傾向を見せ、また試料溶液の電解質濃度(NaNO3濃度)が高いほど、低い値が得られる結果となりました。
Na型モンモリロナイトへのEuの収着メカニズムとして、酸性pH領域ではイオン交換反応、中性pH領域以降では表面錯生成反応を仮定し、それぞれ以下のような式で表しました。
イオン交換:
γ (≡ RNa+) + Eu3+ ⇔ ≡Rγ Eu3+ + γNa+
表面錯生成:
≡SO− + H+ ⇔ ≡SOH,
≡ SOH + H+ ⇔ ≡SOH2+ ,
≡ SO− + Na+ ⇔ ≡SONa,
≡SO− + Eu(OH)n(3-n) ⇔ ≡SO2+{Eu(OH)n}2−n(n = 0 − 3)
一方、Na型モンモリロナイト表面に収着したEuの化学状態を調べるため、時間分解型レーザー蛍光分光法(TRLFS)測定も合わせて行いました。TRLFSはパルス状のレーザーを試料に照射することによって、試料を励起し、励起状態からの脱励起する過程における発光を測定することで対象とする元素の配位状態を調べる方法です。下に示すのはNa型モンモリロナイト表面に収着したEuのTRLFSスペクトルです。ピークの時間変化を測定することにより、3つの異なる寿命を持つ成分からスペクトルが構成されていることが分かりました。ファクターAおよびBは、イオン交換および表面錯生成したEu3+、ファクターCはNa型モンモリロナイト表面でのEu(OH)3沈殿に起因するものと考えています。

コロイドの生成
放射性核種は、加水分解反応などにより真性コロイド(水酸化物コロイド)を形成したり、緩衝材のベントナイトから発生するコロイドや天然に存在する地下水中のコロイドに収着(議事コロイド)したりします。 放射性核種がコロイド化した場合、地下水中での移行挙動は溶存種とは異なる挙動を示し、移行が促進されたり、遅延されたりします。コロイドの移行特性を理解するためには、コロイドの粒径分布や表面電位など コロイドの状態を把握する必要があります。
私たちの研究室では、これまで特にアクチノイドの水酸化物コロイドに着目し、その粒径分布や表面電位を調べるとともに、これらコロイドの状態を予測する手法の確立を目指しています。 下の図は、4価アクチノイドの化学アナログ元素である4価ジルコニウムの水酸化物コロイドの粒径分布を異なる孔径のろ過フィルターを用いた限外ろ過によって調べた結果です。水溶液中にある粒径分布をもったコロイド種が存在する場合、ろ過フィルターの目が粗い(孔径が大きい)ほど、ろ液に含まれるジルコニウム濃度は高くなります。図では数nmサイズの水酸化物コロイドが存在することが示唆されています。

さらに、このコロイド種の粒径分布の実験値を再現するため、単純なポリマーモデル(Flory-Schurtz分布)の適用を試みました。このモデルでは、加水分解種がランダムな方向に結合することによってコロイドを形成すると考えます。
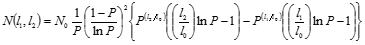
上の式でN(l1,l2)が大きさl1とl2の間に存在するコロイドの数、N0は単一ユニット(単核の加水分解種)の総数、Pは単一ユニットの結合確率、l0は単一ユニットの大きさを表します。この式を用いて粒径分布の実験値の再現を試みた結果を併せて図に示しています。
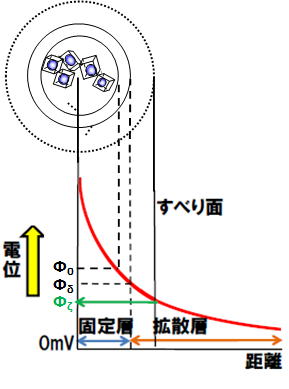
また、最近では水酸化物コロイドのゼータ電位を測定し、その解釈を進めています。コロイドが電解質溶液中に存在するとき、表面における電位を表面電位(Φ0)といい、表面近傍の正負のイオンは表面電位の大きさにしたがって束縛され、電気二重層を形成します。コロイド表面の吸着層をシュテルン層といい、シュテルン面における電位をシュテルン電位(Φδ)、さらに外側の“滑り面”における電位をゼータ電位(Φζ)と呼びます(下図)。このため、電気泳動などで実測されるゼータ電位は、コロイドの表面電位と電解質溶液の条件を反映した値です。コロイドの凝集分散や岩盤の亀裂中の移行は、コロイドのゼータ電位の大きさに左右されるため、コロイドの移行挙動を評価するためには、ゼータ電位の予測手法の確立が重要と考えています。
アクチノイドイオンの見かけの溶解度
放射性廃棄物に含まれるアクチノイド元素は、地下水中で多価イオン(III,IV,V,VI)として存在します。特に4価イオンは強い加水分解反応により難溶性の水酸化物/酸化物固相として沈殿するため、処分環境におけるアクチノイド元素の移行量は、総量(インベントリ)ではなく、水酸化物/酸化物の溶解度に左右されます。
一般に、溶解度は溶解度制限固相の溶解度積(Ksp)により決まります。これまで、4価アクチノイド水酸化物/酸化物の溶解度制限固相を、バルク成分である非晶質(アモルファス)水酸化物(An(OH)4(am))または結晶酸化物(AnO2(cr))に代表させ、Kspの既報文献値の整理が試みられてきました。しかし、既往研究ではAn(OH)4(am)とAnO2(cr)の中間に位置するようなKsp値が数多く報告されており、4価アクチノイド水酸化物/酸化物の溶解度は単純なバルク成分のAn(OH)4(am)またはAnO2(cr)のKspのみで解釈できないことを示唆しています。
私たちの研究室では、溶解度を支配する4価アクチノイドの水酸化物/酸化物の固相状態に着目しています。水酸化物/酸化物固相の溶解度を実測するとともに、固相の粒径や表面状態などの観察を進め、溶解度との関連について検討しています。
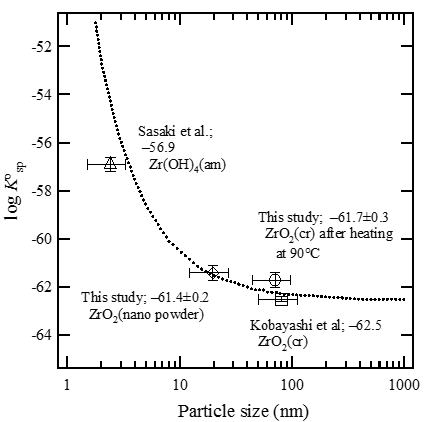
4価ジルコニウム水酸化物の溶解度に及ぼす温度影響
地層処分環境は、廃棄体からの発熱や地熱の影響によって25℃より高い温度にさらされます。このような昇温環境下では、4価アクチノイドのアモルファス水酸化物固相の脱水結晶化が進行し、溶解度制限固相が変化すると考えられます。そこで、25℃から90℃で熟成したジルコニウム水酸化物の溶解度を測定するとともに、固相のX線回折や電子顕微鏡による観察を行いました。
下の図は、各温度で熟成した水酸化物の溶解度を示しています。90℃で熟成した場合、ジルコニウム水酸化物の溶解度は、初期のZr(OH)4(am)の溶解度に比べて大きく低下することが示されています。透過型電子顕微鏡による観察では、25℃での固相は数nmの小さな粒子がネットワーク状に集まっているのに対して、90℃では数10nmサイズの大きな結晶が見られています。それぞれの熟成温度(Ta)での溶解度積を以下のように表し、溶解度から各固相の溶解度積の値を求めました。
Zr(OH)4(s, Ta) ⇔ Zrr4+ + 4OH-
Ksp,Ta=[Zr4+][OH-]4
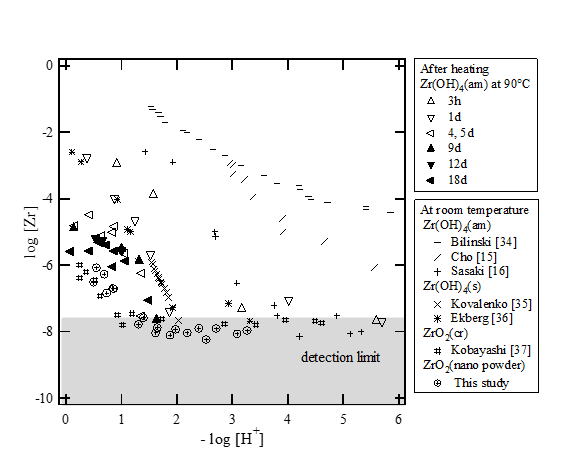

下の図は、溶解度積と固相粒子のサイズの関係を表した図です。固相粒子を均一な球体と仮定したとき、粒子サイズが小さいほど固相の単位モルあたりの表面積が大きくなり、溶解度が大きくなることが知られています。ジルコニウム水酸化物固相の溶解度積と固相粒子サイズの関係もこれと近いような傾向を示すことが分かりました。