1998.8.8 I.Takagi
(概要)
気体分子間の位置エネルギー(ポテンシャル)を数式を用いて近似的に表した一例で、気体分子の輸送現象(平均自由行程、拡散、粘性など)を考える場合に必要な、気体分子の直径を与える。 Lennard-Jones (1894-1954) は英国の物理化学者。
(一般形)
分子間に働く力は分子間の距離Rが大きいと0であり、充分小さいと斥力であり、適当な大きさだと引力(ファン・デル・ワールス力)である。分子間の位置エネルギーU(ポテンシャル)をRの関数と考え、
U = Cm/Rm - Cn/Rn (1)
と表したものを、Lennard-Jones のポテンシャルと言う。 Cm と Cn は定数であり、右辺第一項は斥力を、第二項は引力を表す。
(12,6 ポテンシャル)
(1)式において、m=12、n=6 とした場合のポテンシャルは (12,6)-ポテンシャルと呼ばれ(注1)、以下の形の式がよく用いられる。
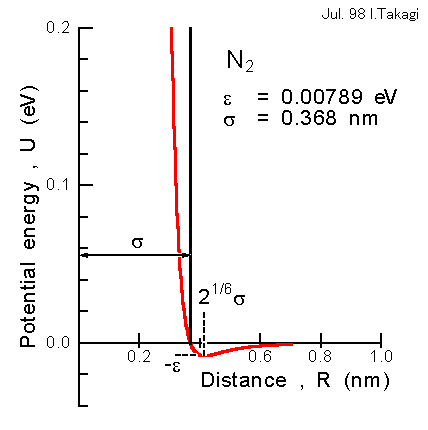
U = 4ε{(σ/R)12-(σ/R)6} (2)
パラメータは ε と σ の2つであり、それぞれ、ポテンシャルの最小値と U=0 の場合の分子間の距離に対応している(次項参照)。σの値は、平均自由行程を求める場合の分子直径として一般に用いられる。
(具体例-窒素ガスの場合)
粘性係数から求められた窒素ガスについてのε、σの値(注2)を (2)式に代入し、得られたポテンシャルを下図に赤線で示す。

(分子直径)
分子の運動エネルギーの目安を kT(kはボルツマン定数)とすると、上図の窒素ガスの例では ε/k = 91K であり、ポテンシャルの最小値εは常温における運動エネルギーに較べると随分小さいことが分かる。また、T = 300K として、U = kT となる R の値を求めると 0.93σ であり、σよりも 7% ほど小さいだけである。以上のことから、σの値を分子直径とみなす剛体球ポテンシャル(上図の黒線)は、常温付近ではよい近似として成り立つことが分かるであろう。ヘリウム、アルゴン、水素ガス、酸素ガス等についても同様のことが言える。
(注1)(6,12)ポテンシャルと表記されることもあるが、ここでは P.W.Atkins の "Physical Chemistry" の表記に従った。 (注2)「メイアン 大学の化学Ⅰ」廣川書店(1972)p87.の表2.6から抜粋した。
以上
このページは、高木郁二が担当している京都大学工学部物理工学科の講義・実験を補う資料として作成したものです。ご意見・お問い合わせはこちらまでお願いします。